

近期,甘李药业在2024年美国肥胖症周(ObesityWeek)年会中首次公布了胰高血糖素样肽-1受体激动剂(GLP-1RA)双周制剂GZR18注射液(通用名:博凡格鲁肽)的一项IIb期临床研究的积极结果:每两周一次GZR18注射液在肥胖/超重受试者中减重效果显著,治疗30周平均最高可减重17.29%,且药物安全性和耐受性良好,这为即将开展的GZR18注射液在肥胖/超重人群中的III期临床研究提供了有力的数据支持与信心。

GZR18注射液IIb期研究主要研究者、北京大学人民医院纪立农主任担任本次口头报告讲者
关键结果一览
肥胖或超重受试者接受每两周一次12 mg、18 mg、24 mg、48 mg以及每周一次24 mg GZR18注射液治疗30周后,平均体重较基线变化百分比分别为-11.15%、-13.22%、-14.25%、-17.29%和-17.78%,安慰剂组为-0.99%;且30周时,GZR18注射液组受试者体重仍在持续下降。
每两周一次48 mg与每周一次24 mg GZR18注射液的疗效和安全性相当,治疗30周后两组间受试者平均体重较基线变化百分比无显著差异(单侧检验,P>0.025)。
GZR18注射液安全性、耐受性良好,最常报告的不良事件为胃肠道反应,与同类药物相当。
前言
GLP-1受体激动剂(GLP-1RA)凭借其显著的减重效果,目前已广泛应用于临床体重管理。对于亚洲肥胖患者,已上市的GLP-1RA产品在此人群中可减重约12-15%1-2。在此基础之上,甘李药业自主研发的新型GLP-1RA GZR18注射液进一步优化了剂量方案和给药频率,并在中国肥胖/超重人群中进行了一系列临床研究以探索药物安全性与有效性。今年6月,GZR18注射液的Ib/IIa期临床研究数据在美国糖尿病协会(ADA 2024)年会上公布,结果显示GZR18注射液每周一次(QW)和每两周一次(Q2W)治疗35周后,中国肥胖症受试者的平均体重分别减轻了17.8%(QW)和12.8%(Q2W)3。此次在Obesity Week年会上公布的最新IIb期临床研究数据进一步验证了GZR18注射液作为双周制剂在中国成人肥胖/超重患者中的疗效与安全性,并为即将开展的III期临床研究提供了坚实依据。
GZR18中国IIb期试验设计
试验标题
在中国成年肥胖/超重受试者中评价GZR18注射液疗效和安全性的多中心、随机、对照Ⅱ期临床研究
临床试验登记号:CTR20231695
关键纳入标准
男性或女性18-75岁(包含界值)
肥胖者(BMI≥28 kg/m2)或超重者(24 kg/m2≤BMI<28 kg/m2)并伴有合并症
体重稳定≥12周
试验设计
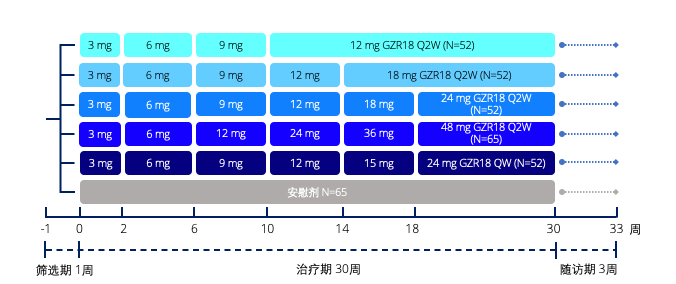
给药剂量
每两周一次(Q2W)
GZR18注射液 12 mg、18 mg、24 mg、48 mg
安慰剂
每周一次(QW)
GZR18注射液 24 mg
安慰剂
研究终点
主要终点:研究结束(第30周)时体重相对基线变化的百分比
关键次要终点:
体重较基线降低≥5%、10%、15%、20%的受试者比例
试验期间发生的不良事件的数量
主要研究结果
在GZR18注射液Q2W各剂量组中,受试者体重呈剂量依赖性下降:12 mg、18 mg、24 mg和48 mg组体重分别降低11.15% (1.04)、13.22% (0.95)、14.25% (1.01)和17.29% (0.99);24 mg QW组体重降低17.78% (1.01),而安慰剂组体重变化为-0.99% (0.91)。
48 mg Q2W与24 mg QW组间减重效果无显著差异(单侧检验P>0.025),表明每两周一次GZR18注射液在降低注射频率提供便捷性的同时能兼顾疗效。
在48 mg Q2W组中,体重减轻≥5%、10%和20%的受试者比例分别为97.8%、82.2%和37.8%。
安全性方面,GZR18注射液表现良好,主要不良事件为轻至中度胃肠道相关不良事件,未见严重不良事件。
*试验数据以均值(标准误)形式表示
讨论与未来
剂量提升带来显著减重效果
得益于出色的药物耐受性与安全性,GZR18注射液在此次IIb期临床研究中成功将给药剂量提升至48 mg,进一步增强了药物的减重效果。相较于Ib/IIa期研究中的30 mg剂量,本次IIb期研究中每两周一次的48 mg剂量使受试者实现了更显著的体重降幅(-12.8% vs -17.3%),展现出剂量递增在体重管理中的显著潜力3。这一结果初步验证了GZR18注射液在肥胖管理中剂量递增策略的应用,未来有望在III期临床研究中进一步探索更合理的剂量调控以优化疗效。随着GZR18注射液在不同剂量和给药频率下研究结果的逐渐公布,其为肥胖患者提供个体化治疗方案的可能性大大增强,这也为未来GLP-1RA药物的临床应用提供了新思路。
单靶点疗效媲美多靶点治疗
作为一款单靶点GLP-1RA药物,GZR18注射液在本次II期研究中每两周或每周一次治疗30周后,肥胖/超重受试者平均体重降幅已达到约18%,并且减重效果尚未到达减重平台期。这一数据超过了GLP-1R/GIPR双激动剂替尔泊肽(Tirzepatide)在中国肥胖人群III期研究(经安慰剂调整后52周体重减轻15.2%)中的表现,且与GLP-1R/GCGR双激动剂玛仕度肽(Mazdutide)在中国肥胖人群II期研究(经安慰剂调整后48周体重减轻18.6%)的效果相当2,4。这表明多靶点GLP-1RA的减重效果并未普遍展现出比单靶点药物更显著的优势,单靶点GLP-1RA通过适当的剂量调整,依然能够实现显著的减重效果,因此专注于单靶点药物的研发仍然具有重要意义。
双周给药实现与单周相似的疗效
在本次IIb期临床研究中,每两周一次48 mg剂量的GZR18注射液与每周一次24 mg剂量在30周的减重效果上无显著差异。这表明双周制剂不仅具有与单周制剂相似的疗效,还为患者提供了更便捷的治疗方案,减轻了频繁注射的负担。研究显示,GLP-1RA单周制剂在初始治疗阶段通过减少注射频率显著提高了患者的依从性。然而,随着治疗时间的延长,周制剂和日制剂的疗效逐渐趋于一致,部分患者因疗效不佳而终止治疗5。GZR18注射液作为兼具高效和便捷的新一代GLP-1RA药物,有望通过双周制剂方案提升患者的长期依从性和满意度,为减重治疗的持久性带来创新。未来,双周制剂在不同患者群体中的适用性有望进一步拓展,从而推动GLP-1RA类药物的广泛应用与长期获益。
参考文献
1. Mu Y, Bao X, Eliaschewitz FG, et al. Efficacy and safety of once weekly semaglutide 2.4 mg for weight management in a predominantly east Asian population with overweight or obesity (STEP 7): a double-blind, multicentre, randomised controlled trial. Lancet Diabetes Endocrinol. Mar 2024;12(3):184-195. doi:10.1016/S2213-8587(23)00388-1
2. Zhao L, Cheng Z, Lu Y, et al. Tirzepatide for Weight Reduction in Chinese Adults With Obesity: The SURMOUNT-CN Randomized Clinical Trial. JAMA. Aug 20 2024;332(7):551-560. doi:10.1001/jama.2024.9217
3. LINONG JI, WEI CHEN, RUIHUA DONG, MINGXIA YUAN, DONG ZHAO, SHUGUANG PANG, LIYUAN ZHAO, JING ZHAO, ZHONG-RU GAN; 1858-LB: A Novel GLP-1 Analog, GZR18, Induced an 18.6% Weight Reduction in Subjects with Obesity in a Phase Ib/IIa Trial. Diabetes 14 June 2024; 73 (Supplement_1): 1858–LB. https://doi.org/10.2337/db24-1858-LB
4. https://www.innoventbio.com/InvestorsAndMedia/PressReleaseDetail?key=407
5. Polonsky WH, et al. Diabetes Ther. 2022;13(1):175-187
关于甘李药业
甘李药业股份有限公司(简称:甘李药业,股票代码:603087.SH)作为中国第一家掌握产业化生产重组胰岛素类似物技术的高科技生物制药企业,具备完整胰岛素研发管线。
目前,公司拥有六款核心胰岛素产品,包括五个胰岛素类似物品种:长效甘精胰岛素注射液(长秀霖®)、速效赖脯胰岛素注射液(速秀霖®)、门冬胰岛素注射液(锐秀霖®)、预混精蛋白锌重组赖脯胰岛素混合注射液(25R)(速秀霖®25)、门冬胰岛素30注射液(锐秀霖®30);以及人胰岛素品种:预混精蛋白人胰岛素混合注射液(30R)(普秀霖®30),产品覆盖长效、速效、预混三个胰岛素功能细分市场。同时,公司产品覆盖相关医疗器械,包括可重复使用的胰岛素注射笔(秀霖笔®)和一次性注射笔用针头(秀霖针®)。
在 2024 年中国胰岛素接续采购中,甘李药业的胰岛素类似物集采协议量在所有中选企业中排名第一。公司的国际化进程也在不断推进,一次性注射笔用针头(秀霖针®)在2020年获得美国食品药品管理局(FDA)批准。同时,2024年公司通过了欧洲药品管理局(EMA)的 GMP 检查。这标志着公司在国际和国内市场上的竞争力得到大幅提升。
未来,甘李将努力实现糖尿病治疗领域的全面覆盖,进一步提升公司在糖尿病治疗领域的市场竞争力。公司还将积极开发新的化学药和生物新药,重点关注代谢性疾病、心血管疾病和其他治疗领域。